美国FDA规定从事医疗器械生产、制备、传播、合成、或加工的出口到美国的美国境外企业,需要向FDA指定一名美国代理人。
美国代理(必要条件)
1. 美国代理必须居住在美国或者在美国有一个商业场所;
2. 美国代理不仅仅只是接听服务,必须在正常的工作日可以保证或有职员接听FDA的电话。
美国代理的职责,包括但不限于:
1. 协助FDA与境外制造商沟通;
2. 协助境外制造商在进口产品或提供进口到美国时相应问题的回复;
3. 协助FDA对境外制造商的安排审厂;
4. 如果FDA不能直接或较快的联系到境外制造商,FDA会提供信息或文档给美国代理人,该行为被认为等同于向境外制造商提供了相同的信息或文档。
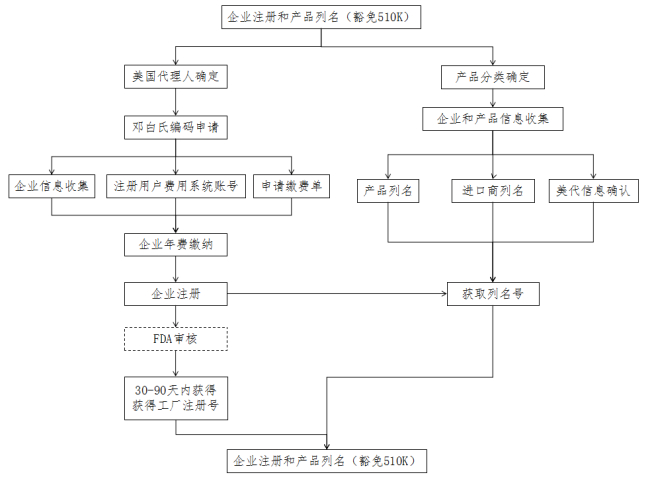
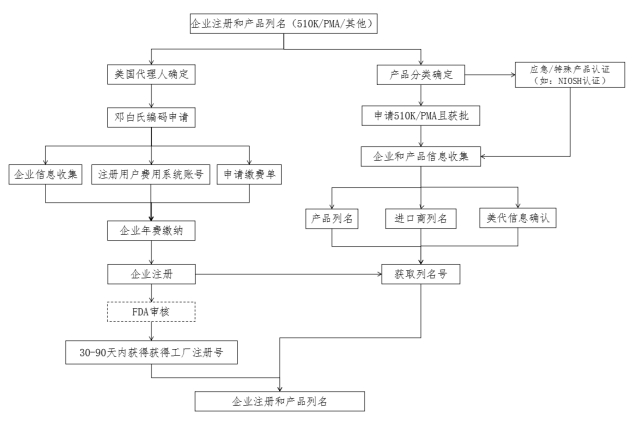
流程图
通用法规
CFR - Code of Federal Regulations Title 21
PART 807 Establishment registration and device listing for manufacturers and initial importers of devices
官方时间和费用
(2022财年)
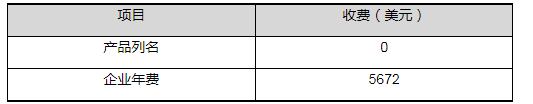
* 每个财年的年费都不相同,FDA会在下一个财年开始之前将新一财年的年费公布在官方网站上,以及更新在User Fee system里。费用的缴纳以FDA官方实际公布的为准。
官方时间
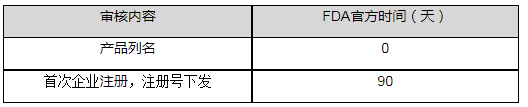
企业注册、列名及年费
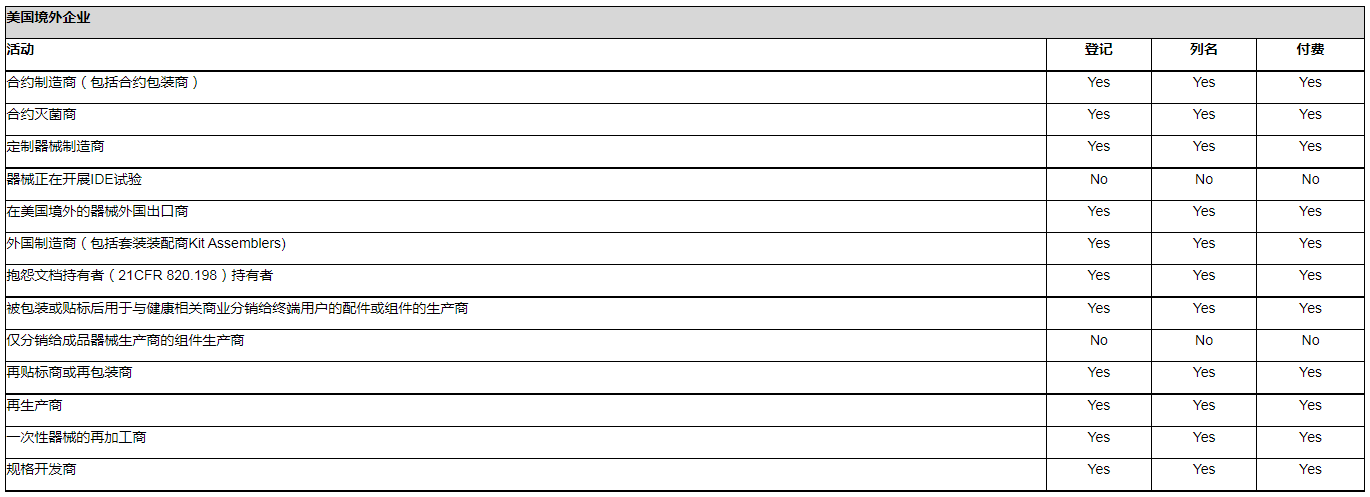
参与到在美国进行商业流通的医疗器械的生产和销售的企业,都要求在FDA进行年度注册。以下表格列出了不同企业类型关于注册、列名及是否需要付年费的具体要求。