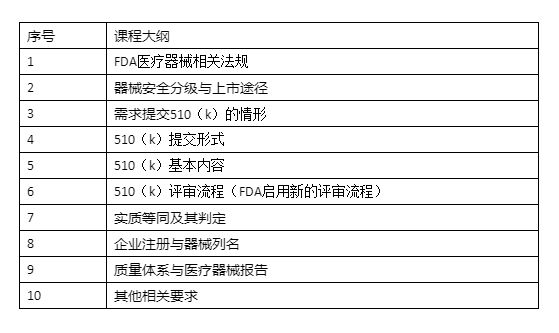
FDA医疗器械法规包括器械上市前和上市后两大部分,其中上市前部分的核心是“上市前批准(PMA)”和“上市前通告(PMN,也即510(k))”;上市后部门的核心为“医疗器械质量体系法规(QSR820)”和“医疗器械报告(MDR)”。
510(k)为医疗器械在美国上市的主要途径之一,绝大多数的II类医疗器械和部分I类、III类医疗器械通过此途径清关上市。随着我们医疗器械行业的发展,特别是行业交流的日益频繁,医疗器械出口美国的需求越来越强烈。本次培训中,卓远天成的医疗器械咨询专家将为您提供FDA相关的法规介绍、510(k)的内容、格式以及FDA510(k)新的评审流程和关注点。该课程内容充实、案例丰富、条理清晰、重点突出,通过本课程的学习,您将对美国医疗器械法规,特别是FDA510(k)涉及到的若干主题有一个更清晰地认识。
参加对象:
管理者代表
总工程师
研发经理
质量经理
产品注册专员
标准和法规工程师
风险管理工程师
项目经理
研发工程师
工艺工程师
质量工程师
课程大纲: